|
||
 |
Dosage Titrage |
Dosages par étalonnage : - spectrophotométrie Établir l’équation de la réaction support de titrage à partir d’un protocole expérimental.
|
| Baccalauréat S physique-Chimie Antilles septembre 2008 (extrait). | ||
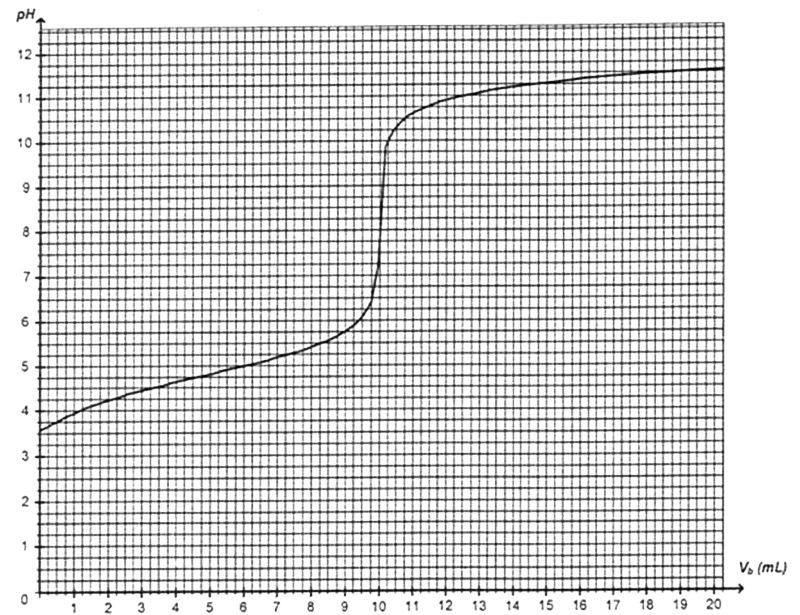
Acide carboxylique inconnu.
1. Titrage de l’acide carboxylique
(notée Na+(aq) + HO– (aq)) de concentration molaire Cb = 2,5 x 10 –2 mol.L–1. On note Vb le volume de solution aqueuse d’hydroxyde de sodium versé. Le suivi pH-métrique du titrage permet d’obtenir la courbe donnée ci-dessous.
1.1. Faire un schéma légendé du dispositif expérimental utilisé pour effectuer ce titrage. 2.5. Identification de l'acide inconnu. Enoncé modifié. L’équation de la réaction de l’acide carboxylique inconnu avec l’eau s’écrit L’expression de la constante d’acidité A partir du tableau de valeurs des constantes d’acidité KA et de la courbe de titrage ci-dessus, identifier l'acide inconnu.
|
||
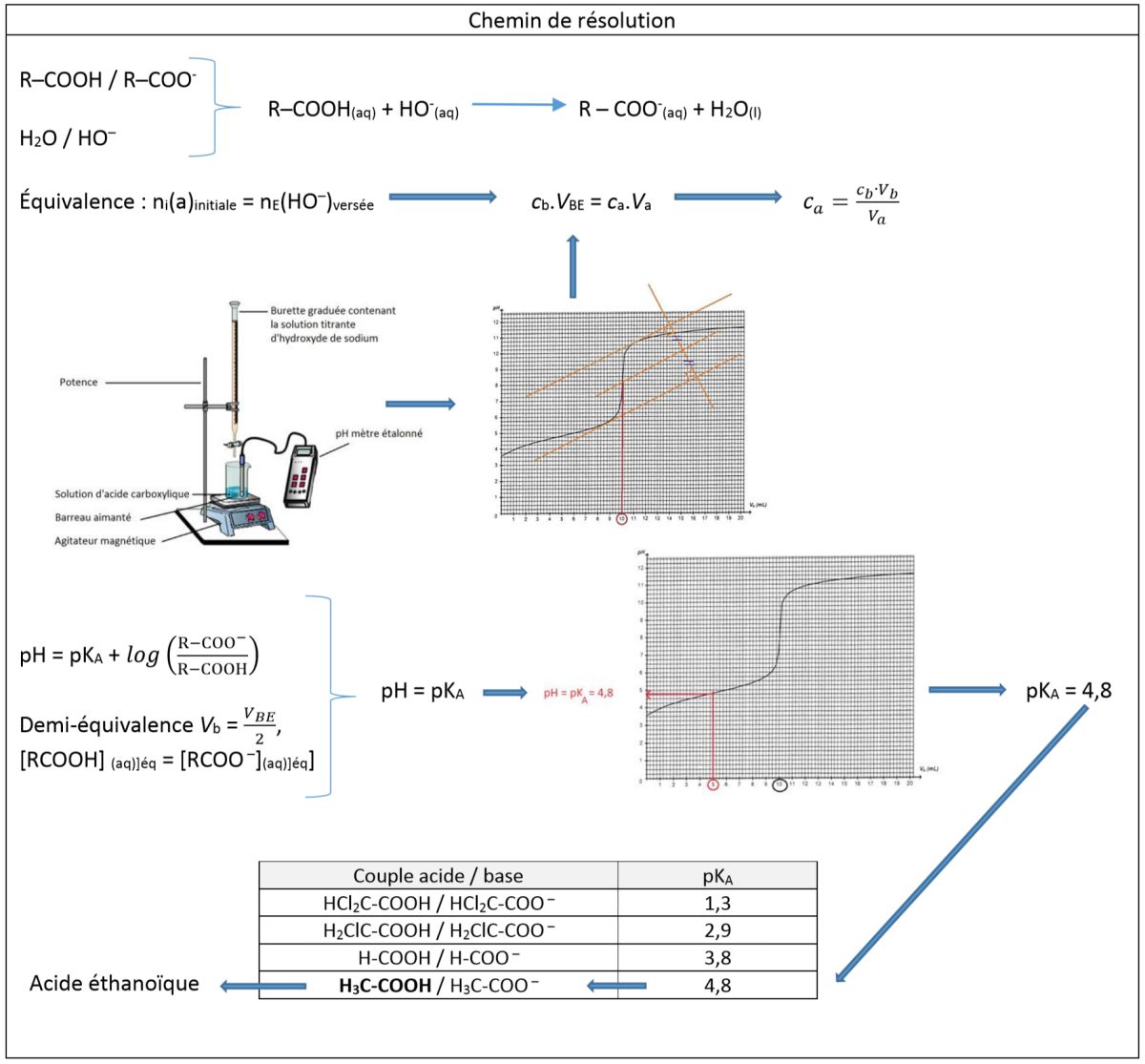
Aide schématique à la résolution de l'exercice
|
||

 Programme officiel (Extraits)
Programme officiel (Extraits)