|
||
 |
pH, pKA, Acide Base |
Reconnaître un acide, une base dans la théorie de Brönsted. Utiliser le symbolisme d'une simple flèche ou d'une double flèche dans l'écriture d'une réaction chimique. Identifier l’espèce prédominante d’un couple acide-base connaissant le pH du milieu et le pKa du couple. Mettre en œuvre une démarche expérimentale pour déterminer une constante d’acidité. Fiche de révision et d'approfondissement sur acide/base vs oxydant/réducteur
|
| Baccalauréat S Physique-Chimie Antilles 2013 (extrait) | ||
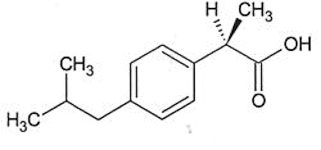
L’ibuprofène. Formule de l’ibuprofène :
On note, l’ibuprofène R–COOH. 3.4. À quel couple acide/base appartient l’ion hydroxyde HO– ? Calculer le pH de cette solution aqueuse dans l’hypothèse d’une solution diluée. Données :
|
||
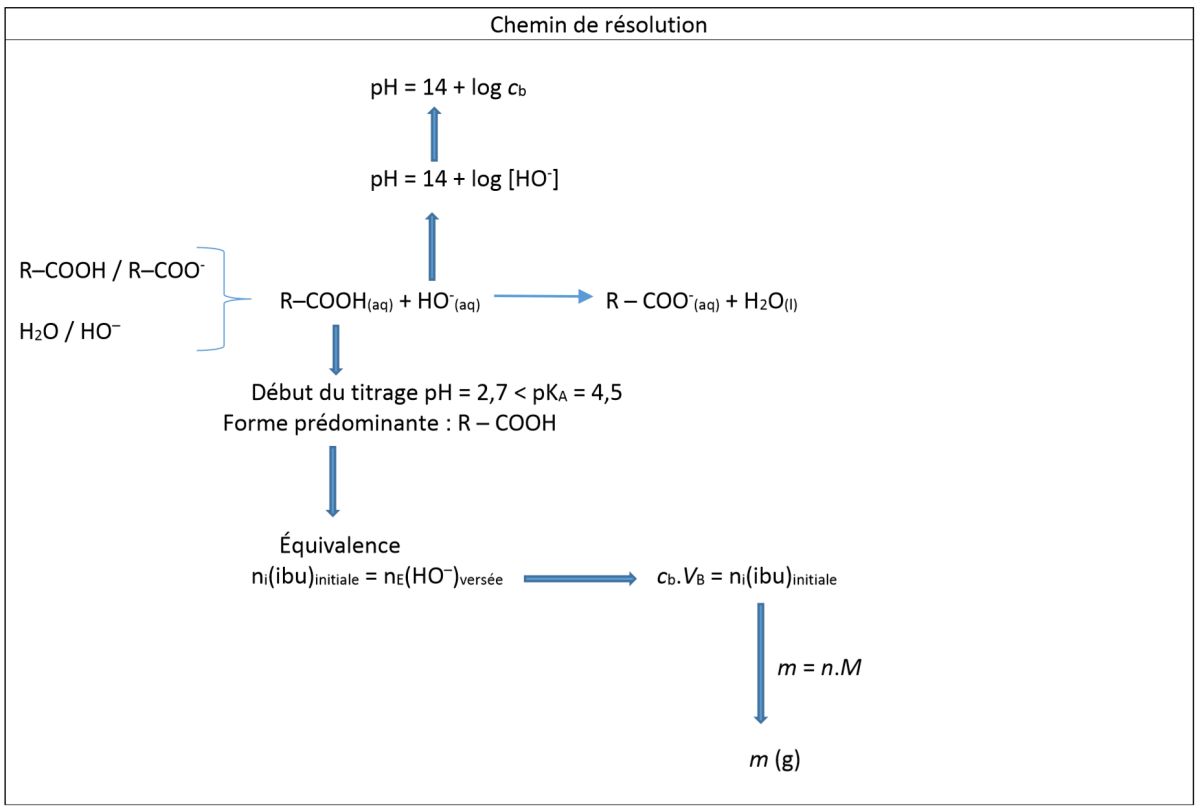
Aide schématique à la résolution de l'exercice
|
||

 Programme officiel (Extraits)
Programme officiel (Extraits)